COVID-19-VACCINS: baanbrekende aanpak of onverwacht gezondheidsrisico?
Geschreven door Aleksandra Niedzwiecki, Ph.D. en Matthias Rath, MD
Dr. Rath Research Institute, San Jose, CA 95138, VS.
De pandemie van het coronavirus is omgeven door de angst om het virus op te lopen. Die angst neemt niet af door inconsistente en vaak tegenstrijdige informatie afkomstig van de media en van verschillende wetenschappelijke en politieke autoriteiten. De introductie van een nieuwe generatie anti-COVID-19-vaccins aan het einde van 2020, met beweerde werkzaamheid bij het beteugelen van de pandemie en met sterke media-steun, wekte hoge verwachtingen en heeft de vraag naar vaccinatie gestimuleerd.
Tegelijkertijd, aangezien deze nieuwe soorten vaccins zich nog in de experimentele fase bevinden, zorgen vragen over hun werkzaamheid tegen gemuteerde vormen van virussen en een risico op onverwachte bijwerkingen op de lange termijn, voor terughoudendheid ten aanzien van hun acceptatie.
Deze zorgen worden niet weggenomen door agressieve mediacampagnes of het tot zwijgen brengen van kritische stemmen over vaccinatie, maar eerder het tegenovergestelde. Het vermijden van ‘moeilijke vragen’ roept extra zorgen op en volgens de opiniepeilingen is ongeveer 40% van de Amerikanen nog steeds terughoudend om het vaccin te nemen. Ook in Nederland is er bij verschillende groepen mensen, en met verschillende redenen, terughoudendheid ten aanzien van vaccinatie.
Hier presenteren we een kort overzicht van COVID-19-vaccins, inclusief hun werkingsmechanismen en veiligheidsaspecten.
De weg naar genetisch gemanipuleerde vaccins (GEV’s)
Vaccins worden al meer dan twee eeuwen met succes gebruikt om verschillende infectieziekten te voorkomen. Het eerste succesvolle vaccin werd in 1796 door Edward Jenner ontwikkeld tegen pokken. Sindsdien is de ontwikkeling van vaccins gebaseerd op het gebruik van verzwakte virussen of bacteriën, of op specifieke eiwitten die door de ziekteverwekkers worden gegenereerd. Injectie hiervan kan het immuunsysteem leren deze antigenen te herkennen en een effectieve immuunrespons op te wekken, wat resulteert in bescherming tegen een echte infectie. De ontwikkeling, productie en wettelijke goedkeuring van dit type vaccin duurt lang (ongeveer 10 tot 15 jaar) en gaat gepaard met hoge kosten.
Aangezien maximaliseren van winst de basis is van farmaceutische activiteiten, hebben farmaceutische bedrijven en hun gesponsorde onderzoek geëxperimenteerd met andere technologieën die zouden resulteren in het sneller en goedkoper produceren van vaccins. Deze nieuwe vaccins introduceren de genetische code van pathogenen in onze cellen. Dus in plaats van de infectieuze agentia van buitenaf te leveren zoals bij conventionele vaccins, triggert de ingebrachte genetische informatie de productie van virale of andere pathogene eiwitten door onze eigen lichaamscellen. Deze technologie is getest in diermodellen en onlangs toegepast in slechts enkele menselijke vaccins (bijv. Ebola, HIV, SARS, MERS en andere) met gemengde resultaten.
In 2012 begon het Amerikaanse Defense Advanced Research Projects Agency (DARPA) met het financieren van groepen bij Novartis, Pfizer, AstraZeneca, Sanofi Pasteur en elders om het werk aan RNA-gecodeerde vaccins en therapieën te intensiveren. De opkomst van COVID-19 in 2019 leidde vervolgens tot een dringende behoefte aan effectieve vaccins om de snel uitbreidende pandemie onder controle te houden. In mei 2020 startte de regering-Trump een publiek-privaat partnerschap – Operation Warp Speed - om de inspanningen op het gebied van de ontwikkeling, productie en distributie van vaccins en diagnostiek tegen COVID-19 te coördineren. In december 2020 werden anti-COVID 19-vaccins geproduceerd door Pfizer / BioNTech en Moderna Therapeutics goedgekeurd. Begin januari 2021 werden meer dan 17 miljoen doses verspreid. Andere landen hebben hun eigen vaccinprojecten.
Hoe genetisch gemanipuleerde vaccins tegen COVID-19 werken
De vaccins geproduceerd door Pfizer, Moderna, AstraZeneca / University of Oxford en Janssen (een Johnson & Johnson-bedrijf) passen genetisch veranderd DNA of RNA toe om gastheercellen ertoe aan te zetten eiwitten te maken die specifiek zijn voor een ziekteverwekker. Ze gebruiken de eiwitsynthese-machinerie van onze cellen, die genetische informatie in het DNA als sjabloon gebruikt om het om te zetten in boodschapper-RNA (mRNA) -moleculen. Deze worden vervolgens door het ribosoomsysteem van de cellen vertaald om eiwitten te produceren. De code (sequentie) voor elk eiwit dat een cel produceert, is zowel in DNA (als blauwdruk) als in mRNA (als werkkopie) versleuteld.
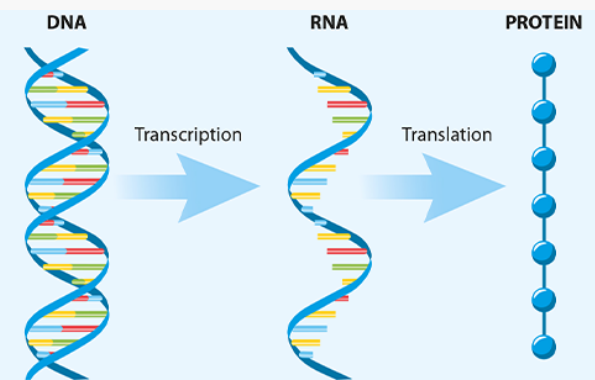
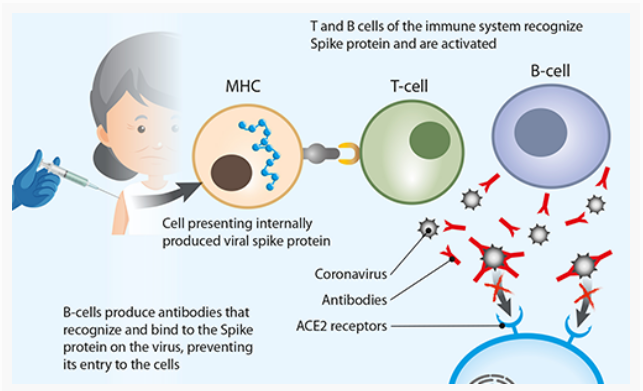
FIG 2. Schematische weergave van hoe een COVID-19-vaccin een reactie van het immuunsysteem teweegbrengt
Hoe mRNA-gebaseerde vaccins werken
De vaccins die zijn ontwikkeld door Pfizer / BioNTech en Moderna Therapeutics bevatten een mRNA-streng die de code bevat voor een SARS-CoV-2-virusoppervlakte-eiwit (bekend als een ‘spike’). Deze spike bindt zich aan de specifieke dockingstations op een doelcelmembraan (de ACE2-receptor) die nodig zijn om virale toegang en infectie op gang te brengen. Daarom kunnen antilichamen die tegen het spike-eiwit zijn gericht, de binding van het virus aan cellen en dus de besmettelijkheid ervan verhinderen.
De mRNA-vaccins bevatten een mRNA-streng met informatie over spike-eiwitten. Dit wordt ingekapseld in lipide-nanodeeltjes (LNP’s) die ervoor zorgen dat RNA door het celmembraan wordt getransporteerd en het tegelijkertijd beschermt tegen afbraak door cellulaire enzymen. Bij injectie komt het mRNA via een vaccin de cellen binnen. Ribosomen vertalen het vervolgens in het virale eiwit en produceren meerdere kopieën die op het celoppervlak worden weergegeven. Het immuunsysteem van het lichaam herkent dit virale spike-eiwit als lichaamsvreemd en ontwikkelt antilichamen en andere immuniteitswapens om het te bestrijden.
De Pfizer- en Moderna-vaccins gebruiken zogenoemd ‘niet-replicerend mRNA’ dat, naast de code voor het spike-eiwit, aan beide uiteinden extra sequenties heeft om een goede RNA-verwerking te garanderen. Volgens de fabrikanten wordt het mRNA afgebroken en gewist zodra het virale antigeen is geproduceerd.
Er zijn ook andere soorten RNA-vaccins in ontwikkeling, zoals het zogenoemde zelf-replicerende mRNA. In deze vaccins is de pathogeen-mRNA-streng verpakt met extra virale replicatiemachines die de gastheercellen in staat stellen viraal RNA te amplificeren en een overvloedige hoeveelheid viraal eiwit te produceren. Dit betekent dat grotere hoeveelheden van het antigeen worden gemaakt uit een kleinere hoeveelheid vaccin voor een robuustere immuunrespons.
orper mattis, pulvinar dapibus leo.

FIG 2. Schematische weergave van hoe een COVID-19-vaccin een reactie van het immuunsysteem teweegbrengt
Hoe mRNA-gebaseerde vaccins werken
De vaccins die zijn ontwikkeld door Pfizer / BioNTech en Moderna Therapeutics bevatten een mRNA-streng die de code bevat voor een SARS-CoV-2-virusoppervlakte-eiwit (bekend als een ‘spike’). Deze spike bindt zich aan de specifieke dockingstations op een doelcelmembraan (de ACE2-receptor) die nodig zijn om virale toegang en infectie op gang te brengen. Daarom kunnen antilichamen die tegen het spike-eiwit zijn gericht, de binding van het virus aan cellen en dus de besmettelijkheid ervan verhinderen.
De mRNA-vaccins bevatten een mRNA-streng met informatie over spike-eiwitten. Dit wordt ingekapseld in lipide-nanodeeltjes (LNP’s) die ervoor zorgen dat RNA door het celmembraan wordt getransporteerd en het tegelijkertijd beschermt tegen afbraak door cellulaire enzymen. Bij injectie komt het mRNA via een vaccin de cellen binnen. Ribosomen vertalen het vervolgens in het virale eiwit en produceren meerdere kopieën die op het celoppervlak worden weergegeven. Het immuunsysteem van het lichaam herkent dit virale spike-eiwit als lichaamsvreemd en ontwikkelt antilichamen en andere immuniteitswapens om het te bestrijden.
De Pfizer- en Moderna-vaccins gebruiken zogenoemd ‘niet-replicerend mRNA’ dat, naast de code voor het spike-eiwit, aan beide uiteinden extra sequenties heeft om een goede RNA-verwerking te garanderen. Volgens de fabrikanten wordt het mRNA afgebroken en gewist zodra het virale antigeen is geproduceerd.
Er zijn ook andere soorten RNA-vaccins in ontwikkeling, zoals het zogenoemde zelf-replicerende mRNA. In deze vaccins is de pathogeen-mRNA-streng verpakt met extra virale replicatiemachines die de gastheercellen in staat stellen viraal RNA te amplificeren en een overvloedige hoeveelheid viraal eiwit te produceren. Dit betekent dat grotere hoeveelheden van het antigeen worden gemaakt uit een kleinere hoeveelheid vaccin voor een robuustere immuunrespons.
orper mattis, pulvinar dapibus leo.
Hoe DNA-gebaseerde vaccins werken
De vaccins van Johnson & Johnson en AstraZeneca gebruiken een andere benadering die bekend staat als een viraal vectorvaccin. Virale vectoren, zoals het gemodificeerde chimpansee-adenovirus (ChAdOx1) in the AstraZeneca vaccin en het human adenovirus (AD26) in het Johnson & Johnson-vaccin, komen uit een grote familie van virussen, waarvan sommige verkoudheid veroorzaken. Het adenovirus-DNA dat is gekoppeld aan de virale genetische code (DNA) voor het SARS-spike-eiwit, wordt gebruikt om virale eiwitinformatie in de celkern in te voegen. De cellen gebruiken die code om viraal spike-mRNA te maken, en uiteindelijk spike-eiwitten. In het complexe proces van SARS-CoV-2-spike-eiwitpresentatie door de cellen, wordt het virale eiwit door het immuunsysteem van ons lichaam als lichaamsvreemd herkend, waardoor een immuunrespons wordt geactiveerd.
Onderzoekers zijn van mening dat grotere hoeveelheden DNA binnen het bereik van 5 tot 20 mg zouden moeten worden geïnjecteerd in een mens van gemiddelde grootte om de immunogeniteit van op DNA gebaseerde vaccins te verhogen. De vaccins van Johnson & Johnson en AstraZeneca zijn producten met een enkelvoudige dosis. Johnson & Johnson test ook een regime met twee doses, waarbij de injecties met een tussenpoos van acht weken worden gegeven. De resultaten van deze proef met 30.000 personen worden pas ergens in mei 2021 verwacht.
Het op COVID-19-DNA gebaseerde vaccin van Johnson & Johnson bevat de volgende ingrediënten: recombinant, replicatie-incompetent DNA van adenovirus type 26 dat het SARS-CoV-2-spike-eiwit tot expressie brengt; citroenzuurmonohydraat; trinatriumcitraat dihydraat; ethanol; 2-hydroxypropyl-β-cyclodextrine(HBCD); polysorbaat-80; natriumchloride.
Het Johnson & Johnson COVID-19-vaccin met een enkele dosis blijft naar schatting twee jaar stabiel bij -20 °C en maximaal drie maanden bij routinematige koeling bij temperaturen van 2 tot 8 °C. Er wordt gewerkt aan een betrouwbare productie van vaccins die geschikter zijn voor gebruik in landen met beperkte of geen koelfaciliteiten.
Een andere uitdaging van op DNA gebaseerde vaccins betreft de optimalisatie van transfectie, die zou kunnen worden bereikt door de incorporatie van verschillende parameters zoals een hybride virale / eukaryotische promotor of de optimalisatie van antigeencodons.
Dit heeft echter geen significante vooruitgang in de richting van het gebruik van dit type vaccin bij mensen belemmerd, en ze worden getest in verschillende klinische onderzoeken.
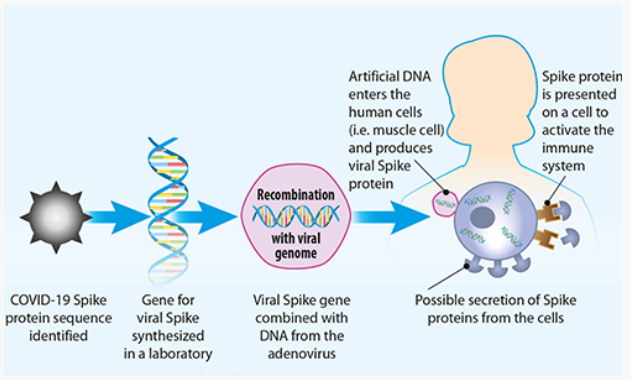
FIG 4. How DNA vaccines work
Goedkeuringsproces voor vaccins
De huidige COVID ‑ 19-vaccins zijn niet goedgekeurd door de Amerikaanse Food and Drug Administration (FDA), maar zijn uitsluitend geautoriseerd voor gebruik in noodgevallen om Coronavirus Disease 2019 (COVID ‑ 19) te voorkomen bij personen van 18 jaar en ouder.
Deze vaccins hebben niet hetzelfde type beoordeling ondergaan als een door de FDA goedgekeurd product. De autorisatie voor gebruik in noodgevallen is toegestaan wanneer aan bepaalde criteria is voldaan, waaronder dat er geen geschikte, goedgekeurde en beschikbare alternatieven zijn. Bovendien is het besluit van de FDA gebaseerd op alle beschikbare wetenschappelijke gegevens waaruit blijkt dat het product effectief kan zijn om COVID-19 te voorkomen tijdens de COVID-19-pandemie, en dat de bekende en potentiële voordelen van het product opwegen tegen de bekende en potentiële risico’s. Aan al deze criteria moet worden voldaan om het product te kunnen gebruiken tijdens de COVID-19-pandemie. Momenteel is er geen door de FDA goedgekeurd vaccin om COVID-19 te voorkomen.
De toelating voor noodgebruik voor het Janssen COVID-19-vaccin is van kracht voor de duur van de COVID-19-verklaring die noodgebruik van deze producten rechtvaardigt, tenzij beëindigd of ingetrokken (waarna de producten niet langer mogen worden gebruikt).
Hoe effectief zijn COVID-19-vaccins in een populatie?
De term ‘werkzaamheid’ verwijst naar de prestaties van het vaccin onder ideale en gecontroleerde omstandigheden, zoals in klinische onderzoeken. De term ‘effectiviteit’ verwijst naar zijn prestaties in reële situaties.
Op basis van klinische onderzoeken claimen de fabrikanten van zowel RNA- als DNA-vaccins een hoge werkzaamheid bij het voorkomen van COVID-19-infecties (ongeveer 90%) bij mensen van 16 jaar en ouder. Een recent groot observationeel onderzoek uitgevoerd in Israël schat dat het Pfizer COVID-19-vaccin 46% effectief is in het voorkomen van infectie 14 tot 20 dagen na de eerste dosis en 92% effectief is 7 dagen na de tweede dosis. De gepoolde resultaten van onderzoeken met het AstraZeneca-vaccin claimen een totale vaccineffectiviteit van 66,7% tegen symptomatische COVID-19 14 dagen na de tweede dosis.
Er is geen bewijs dat een van de huidige COVID-19-vaccins de kans op besmetting van mensen volledig kan stoppen of aanzienlijk kan verkleinen, of dat de overdracht van het virus wordt stopgezet als gevaccineerde mensen besmet raken. Vroeg bewijs suggereert dat in sommige gevallen, wanneer mensen besmet zijn nadat ze volledig zijn gevaccineerd, ze een milder ziekteverloop ervaren dan ze anders zouden hebben.
Eerder waargenomen sekseverschillen in immuunrespons en hormonale status suggereren dat vaccins en therapieën die de immuunrespons van T-cellen op SARS-CoV-2 verhogen, geschikt zouden zijn voor mannelijke patiënten, terwijl degene die de aangeboren immuun-activatie in het vroege stadium van de ziekte dempen, geschikt zouden zijn voor vrouwen. (Takahashi T et al, 2020)
Hoe effectief zijn COVID-19-vaccins tegen gemuteerde vormen van coronavirus?
Sinds de opkomst van de pandemie is het verschijnen van SARS-CoV-2-mutanten een punt van zorg. Dit evolutieproces is continu en stelt het virus in staat om snel veranderingen te selecteren die het efficiënter laten groeien. Elke verandering die de nakomelingen van het virus een concurrentievoordeel geeft, krijgt de voorkeur en begint het oorspronkelijke oudervirus te ontgroeien. Het is dus belangrijk om virussen te controleren op nieuwe mutaties die ze dodelijker, beter overdraagbaar of beide kunnen maken.
Al in februari 2020 werd een substitutie in het spike-eiwit van SARS-CoV-2 gedetecteerd en de D614G-variant genoemd (Korber B et al., 2020). Vier maanden later was deze variant – met een verhoogde besmettelijkheid, hoewel nog steeds met een vergelijkbare ziekte-ernst als zijn oorspronkelijke stam – wereldwijd prominent geworden. Meer recentelijk is een andere, meer overdraagbare stamvariant (B.1.1.7.) Opgedoken in het Verenigd Koninkrijk. De B.1.1.7. variant heeft 17 mutaties, waarvan er 8 in het spike-eiwit zitten. Een van de spike-mutaties, N501Y, is ook gevonden op een andere variant van het virus dat in Zuid-Afrika is geïsoleerd (Reardon S, 2020). Op het moment van schrijven suggereert het nieuwe bewijs dat sommige van deze recente varianten zowel natuurlijke als door vaccins geïnduceerde immuniteit kunnen omzeilen wanneer ze worden getest in laboratoriumtestbuisjes.
De huidige COVID-19-vaccins zetten het immuunsysteem aan om antilichamen te produceren die zich richten op herkenning van het virus-spike-eiwit, dat essentieel is voor de binding ervan aan ACE2-receptoren en het binnendringen van menselijke cellen. Met meerdere wijzigingen in de spike-eiwitsequentie, produceren vaccins die zijn ontworpen voor de oorspronkelijke stam van het virus mogelijk niet langer een sterke immuunrespons tegen nieuwe virusvarianten.
Het opsporen van nieuwe mutaties is een logistieke uitdaging, aangezien het nodig is om de sequentie van virussen uit monsters van geïnfecteerde patiënten te bepalen om varianten te detecteren. De huidige werkzaamheid bij het detecteren van virale mutaties is onvoldoende. De VS bezet, ondanks de meeste infecties, de 43ste plaats in sequentie op de aanwezigheid van coronavirus mutanten. Zuid-Afrika staat op de 42ste plaats. Het Verenigd Koninkrijk staat veel hoger, op de 8ste plaats, met 17% van de patiënten-monsters getest op eventuele mutaties. De leidende landen in dit opzicht zijn Australië en Nieuw-Zeeland.
Veiligheidsaspecten van covid-19-vaccins: bekende, bekende onbekende en onbekende onbekende
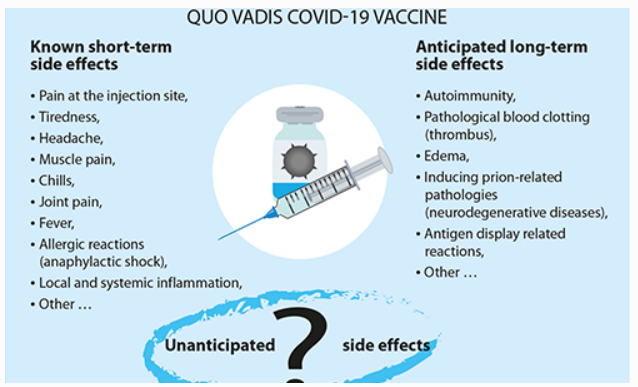
Aangezien het publiek slechts sinds een paar maanden aan COVID-19-vaccinatie is blootgesteld, zijn de bijwerkingen op de lange termijn nog niet volledig bekend. Er is geen duidelijke uitleg gegeven door de fabrikanten hoe lang de spike-eiwitproductie zal voortduren na immunisatie. Langdurige activatie van het immuunsysteem door viraal spike-eiwit zou het risico op een auto-immuunreactie kunnen verhogen. De klinische onderzoeken en bevolkingsvaccinaties die tot nu toe zijn uitgevoerd, hebben uitsluitend gezondheidsproblemen kunnen registreren die zich in korte tijd hebben ontwikkeld. Op het moment van schrijven hebben de regeringen van Denemarken, Italië en Oostenrijk het gebruik van het AstraZeneca-vaccin echter opgeschort na meldingen van dodelijke bloedstolsels bij gevaccineerden, naast meldingen van een overlijden en een ziekte bij mensen die het vaccin gekregen hadden. Ook Nederland, Estland, Litouwen, Luxemburg, IJsland en Letland besloten om vaccins van deze fabrikant op te schorten. Dergelijke incidenten worden natuurlijk krachtig ontkend als toevallig en bestreden door vaccinfabrikanten die hun aandelenkoersen en inkomsten verdedigen.
- Bekende bijwerkingen op korte termijn
Tot dusver waren de meest gemelde bijwerkingen van het Pfizer-vaccin, die doorgaans enkele dagen aanhielden, pijn op de injectieplaats, vermoeidheid, hoofdpijn, spierpijn, koude rillingen, gewrichtspijn en koorts. Meer mensen (ongeveer 20-40%) ondervonden deze bijwerkingen na de tweede dosis dan na de eerste dosis. Volgens rapporten die bij de FDA zijn ingediend, meldde ongeveer 31% van de mensen tussen de 18 en 55 jaar die de tweede dosis van het Pfizer-vaccin kregen, koorts. Met het Moderna-vaccin meldde ongeveer 1% van de 18- tot 64-jarigen koorts na de eerste dosis, terwijl 17 procent aangaf koorts te krijgen na de tweede dosis.
Bijwerkingen zijn doorgaans meer uitgesproken bij jongere mensen dan bij oudere mensen, waarschijnlijk omdat hun immuunsysteem robuuster is.
De meest recente gegevens van de Amerikaanse Centers for Disease Control and Prevention (CDC) laten zien dat ernstige bijwerkingen, zoals anafylactische allergische reacties, optreden in een mate van ongeveer 2,5 gevallen per miljoen toegediende doses van het Moderna-vaccin, en 4,7 gevallen per miljoen doses van het Pfizer-product. Veel van de mensen die anafylaxie hebben ontwikkeld, hebben een voorgeschiedenis van ernstige allergieën, en sommigen hebben eerdere episodes van anafylaxie gehad.
Ernstige reacties, hoewel van voorbijgaande aard, lijken vaker voor te komen bij COVID-19-injecties dan bij andere immunisaties – meer dan 80% van de mensen die het Moderna-vaccin in klinische onderzoeken kregen, had een soort systemische reactie op de injectie, met periodes van vermoeidheid spierpijn en andere problemen die vaak kortstondig invaliderend bleken.
Verontreinigingen die zijn ontstaan tijdens het vaccinsyntheseproces en het toedieningssysteem van nanodeeltjes zijn naar verluidt twee van de belangrijkste bronnen van bijwerkingen. Om deze redenen dienen vaccinfabrikanten vaak lagere doses toe om de blootstelling van een persoon eraan te beperken. Bij mRNA-vaccins betekenen lagere doses echter een lagere potentie.
- Mogelijke bijwerkingen op de lange termijn van GEV-vaccins: bekende onbekenden
Potentiële risico’s verbonden aan op mRNA gebaseerde vaccins. De mRNA-streng in het vaccin kan immuunreacties opwekken, waaronder lokale en systemische ontsteking, auto-immuunreacties door stimulatie van auto-reactieve antilichamen, de biologische verdeling en persistentie van tot expressie gebracht immunogeen en mogelijke toxische effecten van niet-natuurlijke nucleotiden en componenten van het afgiftesysteem. Een mogelijke zorg zou kunnen zijn dat sommige op mRNA gebaseerde vaccinplatforms krachtige type I interferonresponsen induceren (Pepini, T. et al. 2017), die niet alleen in verband zijn gebracht met ontsteking maar mogelijk ook met auto-immuniteit (Theofilopoulos AN et al., 2005) , Nestlé FO et al. 2005).
Een ander potentieel veiligheidsprobleem zou kunnen voortvloeien uit de aanwezigheid van extracellulair RNA tijdens mRNA-vaccinatie. Van extracellulair naakt RNA is aangetoond dat het de permeabiliteit van dicht opeengepakte endotheelcellen verhoogt en zo kan bijdragen aan oedeem (Fischer S. et al. 2007).
Een andere studie toonde aan dat extracellulair RNA de bloedstolling en pathologische trombusvorming bevorderde (Kannemeier C. et al. 2007). Dit zou het recente geval van een dodelijk bloedstolsel bevestigen dat is gemeld met het AstraZeneca-vaccin.
Er moet ook worden opgemerkt dat patiënten met ernstige reacties op de infectie mogelijk meer risico lopen op bijwerkingen van het vaccin (bijv. Cytokinestorm), die kunnen worden uitgelokt door vreemde mRNA-strengen.
Omgekeerd kunnen asymptomatische personen potentiële non-responders op het vaccin zijn. Daarom moet bij de ontwikkeling en toediening van vaccins rekening worden gehouden met de genetische markers die zijn geïdentificeerd als voorspellers van de ernst van COVID-19.
Potentiële risico’s van op DNA gebaseerde vaccins. Veel aspecten van de immuunrespons die door DNA-vaccins wordt gegenereerd, zijn nog steeds niet begrepen. Deze techniek brengt het risico met zich mee dat het genen die de celgroei regelen, beïnvloedt als de vector wordt opgenomen in een kritiek deel van de gastheer-DNA-code, wat ernstige gevolgen kan hebben.
Andere belangrijke veiligheidsproblemen bij op DNA gebaseerde vaccins hebben betrekking op de mogelijkheid om antilichaamproductie tegen DNA te induceren, wat resulteert in auto-immuunziekten, tolerantie te ontwikkelen voor het virale eiwit (antigeen) dat in het DNA is geïntroduceerd, evenals de negatieve gevolgen van nieuwe moleculaire adjuvantia op de gezondheid.
Verdere veiligheidsproblemen zijn onder meer de mogelijke verspreiding van genetisch materiaal naar het milieu via de mogelijke transformatie van de omgevingsmicroflora met slechts een paar kopieën van volledig of gefragmenteerd plasmide.
Andere risico’s. Aangezien COVID-19-vaccins zijn goedgekeurd zonder uitgebreide veiligheidstests op de lange termijn, kunnen ze geen onverwachte risico’s uitsluiten. Voorbeelden zijn onder meer:
- De risico’s van het induceren van op prionen gebaseerde ziekten door intrinsieke eiwitten te activeren om prionen te vormen. Deze verkeerd gevouwen eiwitten veroorzaken verschillende dodelijke en overdraagbare neurodegeneratieve ziekten, waaronder de gekkekoeienziekte bij runderen en de ziekte van Creutzfeldt-Jakob bij mensen. Prionen zijn ook betrokken bij de ziekte van Alzheimer en amyotrofische laterale sclerose (ALS). Een rapport afkomstig van de laboratoria van het Human Microbiology Institute in New York, gefinancierd door de farmaceutische firma Johnson & Johnson, wijst op de aanwezigheid van priongerelateerde sequenties in de COVID-19-spike die niet werden gevonden in andere coronavirussen. Verwacht wordt dat deze sequenties aanwezig kunnen zijn in de spike-eiwitcode in mRNA- of DNA-vaccins.
- Er zijn geen publiekelijk beschikbare gegevens over hoe lang het virale RNA wordt vertaald in een vaccinontvanger en hoe lang het spike-eiwit aanwezig zal zijn op een gastheercel. Dit nieuwe spike-eiwit kan een receptor worden voor andere nog onbekende infectieuze agentia. Het kan ook worden uitgescheiden in de externe omgeving van de cel met onvoorspelbare gevolgen.
- Sommige onderzoekers zijn bezorgd over het potentieel om de genetische diversiteit te beïnvloeden door een identiek viraal spike-eiwit op de cellen van iedereen in de wereldbevolking te plaatsen. Dit zou een identieke potentiële receptor creëren die het doelwit is van andere infectieuze agentia die nog niet bekend zijn. In een dergelijke situatie zou iedereen in de populatie mogelijk vatbaar zijn geworden voor binding van pathogenen met hetzelfde agens.
- Onverwachte bijwerkingen van GEV-vaccins: onbekende onbekenden.
- Naast de vaak waargenomen bijwerkingen, de risico’s van allergische reacties en andere voorspelbare risico’s, kunnen we de mogelijkheid niet uitsluiten dat andere ernstige en onverwachte effecten jaren later kunnen optreden nadat honderden miljoenen mensen van verschillende leeftijden, rassen, etniciteit en gezondheidsproblemen zijn blootgesteld aan COVID-19-vaccins. De identificatie van deze effecten en hun verband met de vaccinatie vormt een enorme logistieke uitdaging. Deze experimentele technologie vraagt daarom om effectieve postmarketingsurveillance.
- Deze recensie vertegenwoordigt het eerste deel van een reeks onderwerpen die verband houden met COVID-19-vaccins. Het volgende deel zal binnenkort de rol van micronutriënten bespreken als een effectieve eerste verdediging tegen infecties, en hun rol als natuurlijke ‘vaccins’ en immuunsysteem-boosters.
Referenties
Callaway E. Fast‐spreading COVID variant can elude immune responses Nature. 2021;589:m4944.500–501.
Fischer, S. et al. Extracellular RNA mediates endothelial-cell permeability via vascular endothelial growth factor. Blood 2007; 110, 2457–2465.
Kannemeier, C. et al. Extracellular RNA constitutes a natural procoagulant cofactor in blood coagulation. Proc. Natl Acad. Sci. USA 2007; 104, 6388–6393
Korber B, Fischer WM, Gnanakaran S, et al. Veranderingen in SARS-CoV-2-piek volgen: bewijs dat D614G de besmettelijkheid van het COVID-19-virus verhoogt. Cell . 2020; 182 (4): 812-827.
Nestle, FO et al. Plasmacytoïde predendritische cellen initiëren psoriasis door interferon-α-productie. J. Exp. Med. 2005; 202, 135
Pepini, T. et al. Inductie van een IFN-gemedieerde antivirale respons door een zelfversterkend RNA-vaccin: implicaties voor het ontwerp van het vaccin. J. Immunol. 2017; 198, 4012-4024.
Reardon S, de coronavirusmutatie in het VK is zorgwekkend maar niet angstaanjagend . Wetenschappelijke Amerikaan. 24 december 2020.
Takahashi T., Yale IMPACT-onderzoeksteam. Ellingson MK, Wong P., Israelow B., Lucas C., Klein J., Silva J., Mao T., Oh JE, et al. Geslachtsverschillen in immuunresponsen die ten grondslag liggen aan de uitkomsten van COVID-19-ziekte. Natuur. 2020: 1-9. doi: 10.1038 / s41586-020-2700-3
Theofilopoulos, AN, Baccala, R., Beutler, B. & Kono, DH Type I interferonen (α / β) bij immuniteit en auto-immuniteit. Annu. Rev. Immunol. 2005; 23, 307-336.


